Abondance de l'eau dans l'Univers
Abondance des éléments chimiques de l'Univers
On appelle « élément chimique », l’ensemble des entités chimiques (les atomes, leurs isotopes et les ions qu’ils forment ...) ayant le même nombre de protons dans leur noyau. Ce nombre, noté Z, est appelé le numéro atomique de l'élément. Au 1er juillet 2009, on a détecté 117 éléments chimiques. Seuls les 112 premiers éléments chimiques (classés par Z croissant) ont été validés par l'IUPAC (Union Internationale de Chimie Pure et Appliquée). Sur ces 112 éléments, 94 existent naturellement ; les autres ont été préparés artificiellement par fusion de noyaux d'éléments plus légers.
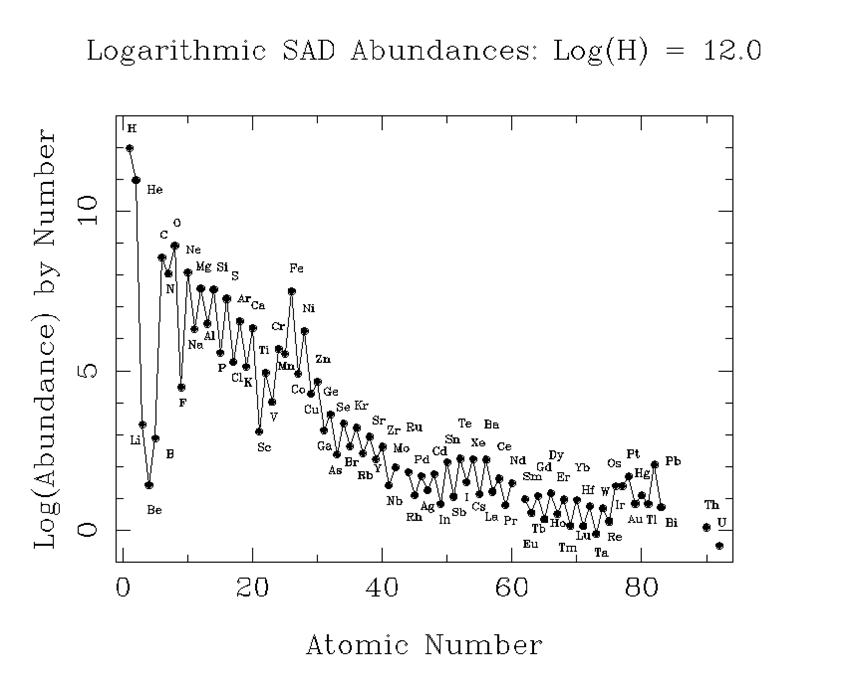
L'hydrogène est l'élément le plus abondant dans notre Univers ; il représente environ 75 % en masse de la matière de l'Univers observable (matière noire exclue). Cet élément ainsi que l'hélium et le lithium sont apparus lors de la formation même de l'Univers (par nucléosynthèse primordiale lors du Big Bang). L'oxygène arrive en 3ème place derrière l'hydrogène et l'hélium. C'est un élément fabriqué au coeur des étoiles par nucléosynthèse stellaire.
La molécule d’eau, de formule H2O est constituée de 2 éléments chimiques, l'hydrogène et l'oxygène. Ces deux éléments étant très répandus dans l'Univers, la molécule d'eau est présente dans tout le cosmos, essentiellement sous forme de glace ou de vapeur.
Comment se forme la molécule d'eau (par Thérèse Encrenaz - société française d'exobiologie)
Comme l'hydrogène est l'élément le plus abondant, la molécule H2O se forme dans le milieu interstellaire à partir de réactions faisant intervenir l'hydrogène atomique H et le dihydrogène H2. Les rayons cosmiques ionisent H et H2 pur former l’ion H3+. Cet ion réagit avec l’oxygène atomique O pour former OH+ et H2, puis H2O+ et H. L’ion H2O+ réagit avec des électrons libres pour former le radical OH et la molécule neutre H2O.
Dans les nuages moléculaires denses et froids, où la température n’excède pas quelques dizaines de degrés Kelvin, la molécule d’eau peut se former directement sous forme de glace, par des réactions chimiques intervenant à la surface des grains, carbonés et/ou silicatés. La grande mobilité des atomes d’hydrogène sur les surfaces froides favorise les réactions chimiques et la formation des molécules d'eau H2O, de méthane CH4 et d'ammoniac NH3.

