Les spectres d'émission
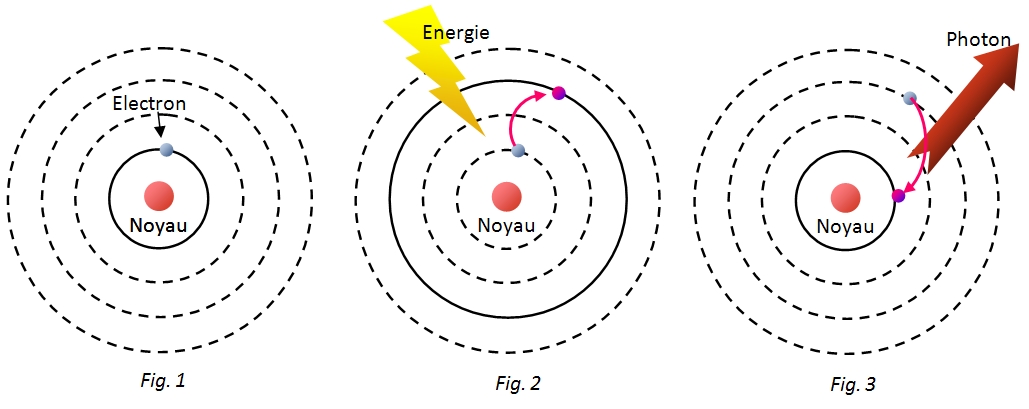
En effet, lorsque l'atome est soumis à une action extérieure qui lui apporte de l'énergie, il se trouve déstabilisé : on dit qu'il se trouve dans un état excité (fig.2). L'électron utilise alors cette énergie pour passer à un niveau d'énergie supérieur (saut quantique). Lorsque l'excitation cesse, l'atome tend à revenir à l'état fondamental en restituant à l'extérieur l'énergie qu'il avait reçue (fig.3). Cette relaxation d'énergie se fait en un temps très court et se traduit par l'émission d'un photon lumineux d'énergie correspondant exactement à celle du saut quantique. Si la relaxation porte simultanément sur un grand nombre d'atomes, on observe un spectre d'émission où sont présentes toutes les radiations correspondant aux photons émis. Ainsi, le spectre d'émission de l'atome d'hydrogène comporte un grand nombre de raies qu'il est possible de classer en séries spectrales. Chaque série spectrale correspond à la relaxation sur un niveau d'énergie donné.
Ce spectre ainsi produit caractérise l'élément chimique présent dans le gaz chauffé. Il constitue une sorte de signature.
On peut retrouver les spectres d'émission de 90 éléments chimiques dans cette application (applet java).

