Aspects biologiques
Aspects biologiques de la maladie
Les maladies du mouvement, comme la maladie de Parkinson, sont liées à des dysfonctionnements des réseaux neuronaux qui contrôlent le mouvement. Connaître la dynamique de ces circuits moteurs permet de mieux appréhender les stratégies thérapeutiques à adopter pour suppléer le déficit fonctionnel induit par la maladie.
Les lésions sont concentrées sur une petite zone du tronc cérébral nommée locus niger ou substance noire en raison de sa pigmentation. Cette découverte est due à Trétiakoff en 1919, un siècle après les travaux de Parkinson.
1. Les lésions observables dans la substance noire :
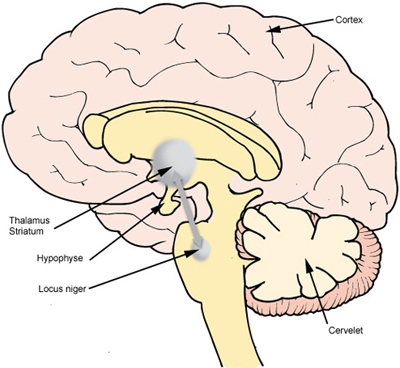
Schéma d'une Coupe sagittale du cerveau (D'après le dossier santé du site de gsk) ©www.gsk.fr
La substance noire est une petite structure nerveuse qui comporte seulement quatre cent mille neurones dont les corps cellulaires envoient des prolongements en direction des neurones d’un gros noyau cérébral le striatum. Le neurotransmetteur qui intervient au niveau des synapses est la dopamine, présente en grande quantité dans la substance noire et dans le striatum car elle s’accumule dans les terminaisons présynaptiques.
Chez les malades, on constate une disparition progressive des neurones de la substance noire. Vient alors le moment où il n’y a plus assez de dopamine pour permettre l’activation du striatum. Le contenu du striatum en dopamine s’effondre.
L’étude du cerveau de parkinsoniens décédés permet de visualiser les lésions. La pigmentation de la substance noire(droite et gauche) a disparu. En effet, à l’état normal, les neurones de la substance noire possèdent un pigment, la mélanine, proche de celui que l’on trouve dans les cellules de la peau et responsable de leur pigmentation. Au microscope, on peut vérifier que la pâleur de la substance noire est bien due à une diminution du nombre de neurones. On note aussi que la réduction du nombre de ces neurones est irrégulière.
Dans certains des neurones restants, on voit des inclusions arrondies, les corps de Lewy caractéristiques de la maladie de Parkinson, il s'agit d'agrégats de protéines cellulaires (neurofilament, alpha-synucléine protéine qui joue un rôle dans l'élaboration des synapses au cours du développement). On ne connaît pas la cause de ces formations, il pourrait s'agir de protéines produites en excès ou de protéines non fonctionnelles.
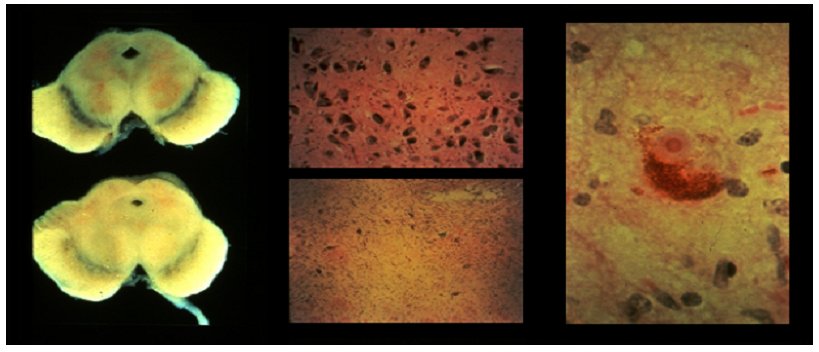
- au centre : observation au microscope optique des neurones de la substance noire chez un individu sain (image du haut) et chez un individu atteint de la maladie de parkinson, raréfaction des neurones à dopamine (image du bas)
- à gauche : coupe transversale montrant la pigmentation de la substance noire chez un individu sain (image du haut) et chez un individu atteint de la maladie de Parkinson (image du bas).
- à droite : observation au microscope optique montrant les corps de Lewy dans les neurones d'un patient parkinsonien.
(photo Marc Savasta : INSERM Grenoble)
2. Mise en évidence d'un déficit en dopamine chez les malades parkinsoniens :
La dopamine est une amine c'est-à-dire un acide aminé qui a perdu sa fonction acide. Elle est produite à partir de la tyrosine qui se transforme en dopa, la dopamine est synthétisée grâce à une enzyme assez répandue dans l’organisme, la dopa-décarboxylase. En 1952, C’est grâce aux travaux d’un chercheur suédois, Carlson, que l’on fait le lien entre l’action de la réserpine et la chute du taux de dopamine. En effet, la réserpine est un médicament provoquant une paralysie catatonique chez le rat et utilisé à l’époque en pathologie humaine pour réduire les délires des malades psychiatriques en provoquant chez eux une raideur musculaire.
Si la réserpine provoquait la déplétion en dopamine dans le cerveau des rats, on pouvait penser que les troubles musculaires de la maladie de Parkinson chez l’homme étaient dus à une réduction du taux de dopamine. C’est ainsi qu’un médecin autrichien Oleh Hornykiewicz trouva des concentrations en dopamine beaucoup plus faibles dans la substance noire et le striatum de cerveaux de parkinsoniens (1960).
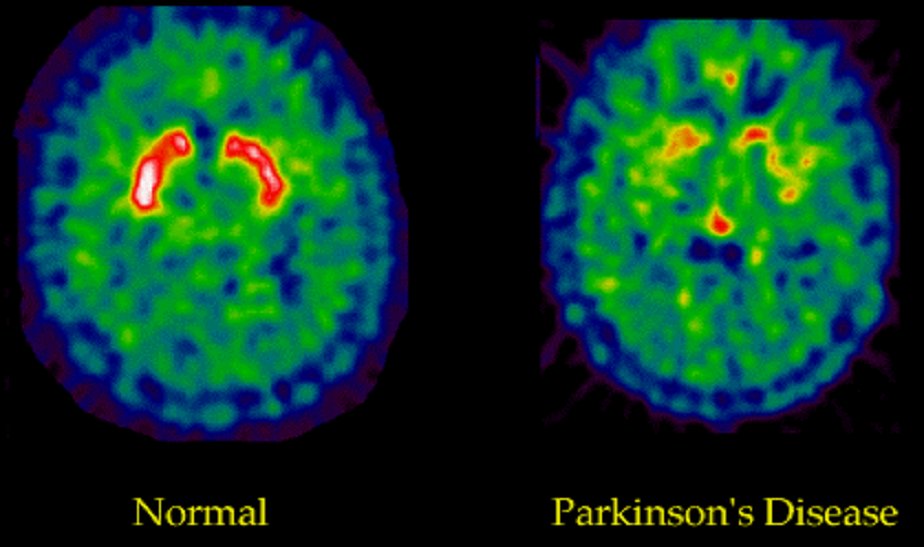
PET- scan : tomographie à émission de positons : la coloration rouge permet d'identifier l'activité dopaminergique dans le striatum.(Photo Marc Savasta : INSERM Grenoble)
3. Rôle de la substance noire :
La substance noire appartient à un ensemble de structures nerveuses qui composent les ganglions de la base, encore appelés noyaux gris centraux. La coupe schématique qui suit précise la localisation des différentes structures sous-corticales : le noyau caudé et le putamen forment le néostriatum, le globus pallidus ou pallidum est divisé en deux parties interne et externe ; ces trois noyaux sont étroitement interconnectés avec le noyau subthalamique et avec la substance noire composée d'une zone réticulée (pars reticulata) ventrale et d'une zone compacte (pars compacta) dorsale et pigmentée de noir.
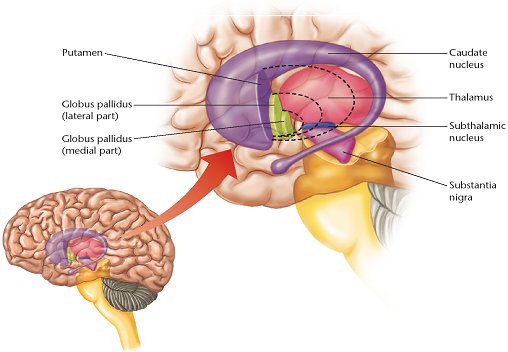
Localisation des ganglions de la base - image Marc Savasta (INSERM Grenoble)
Ces cinq structures nerveuses, associées aux différentes aires du cortex moteur ainsi qu'au cervelet et aux noyaux moteurs du tronc cérébral participent au contrôle de la motricité bien qu'aucune d'elles n'ait de connexion directe avec la moelle épinière. On considère que les ganglions de la base, par leurs connexions afférentes issues des aires associatives, du thalamus et des structures limbiques se situent au cœur des processus d'intégration, de vigilance, de motivation qui permettent à l'individu un choix stratégique selon les besoins du moment.
Les ganglions de la base constituent donc un complexe planifiant l'activité motrice ; leur réseau de neurones reconfigurerait sélectivement l'information corticale de manière à la canaliser vers la zone frontale et les voies motrices. Tout dysfonctionnement de ces noyaux ou de leurs connexions se traduit par une pathologie motrice qui va de la pauvreté des mouvements chez les parkinsoniens jusqu'à un excès de mouvements imprévisibles chez les patients atteints de la maladie de Huntington. Le modèle global du contrôle moteur a été élaboré à partir de données obtenues chez l'animal [parkinsonisme expérimental par intoxication au MPTB (neurotoxine), lésion du noyau subthalamique...], il est présenté ici de façon simplifiée c'est à dire n'impliquant ni toutes les projections ni tous les neurotransmetteurs actuellement connus.
Schéma général du contrôle de la motricité par les ganglions de la base. Schéma modifié d'après "Une expertise collective réalisée par l'INSERM. Troubles mentaux : dépistage et prévention chez l'enfant (2004)
La couleur orange représente des influences excitatrices, la couleur bleue des influences inhibitrices. Les neurotransmetteurs sont signalés entre parenthèses : glu (glutamate), DA (dopamine), enk (enképhaline). D1 et D2 désignent les deux types de récepteurs à la dopamine. GPe (Globus Pallidus externe), GPi (Globus Pallidus interne), SNc (Substance noire pars compacta), SNr (Substance Noire pars reticulata), NST (noyau subthalamique)
Le courant général va du cortex vers les ganglions de la base, où le néostriatum (noyau caudé et putamen) constitue la voie d'entrée tandis que le globus pallidum interne (GPi) et la zone réticulée de la substance noire (SNr) sont les principaux points de sortie vers le thalamus qui renvoie vers le cortex prémoteur et supplémentaire chargés de la programmation du mouvement.
Dans l'organisation générale des circuits cortico-striés on distingue 3 boucles :
- la boucle A : cortico-thalamo-corticale
- les boucles B et B' directe et indirecte
- la boucle C nigro-stiée (contrôle en retour l'entrée du réseau strié)
La boucle motrice principale A s'exprime dans les commandes motrices descendant vers le tronc cérébral et la moelle épinière.
La deuxième boucle revient sur les projections thalamo-corticales, à partir du cortex en passant par le néostriatum et le globus pallidus interne (GPi). Cette boucle à la fois directe et indirecte exerce au niveau thalamique un double effet antagoniste facilitateur pour la boucle directe (B) et inhibiteur pour la boucle indirecte (B') sur la boucle principale (A). Ainsi, en activant les neurones du striatum, qui se projettent sur le globus pallidus interne (GPi) et la substance noire réticulée (SNr), les influx sont à l'origine d'une inhibition de l'activité de ces derniers qui conduit à lever l'inhibition que ces noyaux exerçaient sur le thalamus dont l'activité se trouve renforcée. Dans la voie indirecte, en activant les neurones du striatum qui se projettent sur le globus pallidus externe (GPe), les influx freinent l'activité du GPe qui n'exerce plus d'inhibition sur les neurones du noyau subthalamique (NST); la levée de l'inhibition se traduit par une stimulation des neurones du GPi et de la SNr qui freinent l'activité du thalamus.
La boucle nigro-striée (C) est responsable d'une régulation complexe qui aboutit à renforcer l'activation corticale en soutenant la boucle directe (B) aux dépens de la boucle indirecte (B'). La substance noire pars compacta (SNc), composée de neurones à dopamine reçoit des projections du cortex via des neurones du néostriatum.
Certains neurones à dopamine de la substance noire (SNc) stimulent les neurones du striatum équipés de récepteurs de type D1, ce qui conduit à stimuler l'activité de ces neurones et donc à renforcer l'activité du thalamus (boucle B directe). D'autres neurones à dopamine de la substance noire (SNc) stimulent les neurones du striatum équipés de récepteurs de type D2, ce qui conduit à freiner l'activité de ces neurones du striatum et donc s'opposer aux effets de la boucle indirecte : l'activité du thalamus n'est plus freinée.
Un exemple pour mieux comprendre :
Si l'on prend comme exemple un mouvement simple de flexion d'une articulation, la sélection d'un programme moteur dans le cortex cérébral entraine une excitation par le glutamate des neurones du striatum impliqués dans ce programme : la décharge de ces neurones entraine une excitation des neurones GABAergiques efférents du striatum ; ceux-ci inhibent, par la voie directe, les neurones du pallidum interne impliqués dans ce mouvement et qui exercent en permanence une inhibition de la voie thalamo-corticale. La limitation de cette inhibition a pour effet d'augmenter l'activité des neurones thalamiques impliqués dans le mouvement de flexion et qui activent directement la voie cortico-spinale. L'action du striatum est aussi responsable, par la voie indirecte, d'une désinhibition du noyau subthalamique, qui entraine à la sortie une inhibition des relais thalamiques. Cette activité inhibitrice par la voie indirecte, est cependant limitée par les afférences provenant de la pars compacta de la substance noire qui inhibe la voie striato-pallidale directe. On peut donc dire que la libération de dopamine facilite le circuit activateur du relais thalamique et réprime le circuit inhibiteur thalamique ; l'activité du cortex est donc renforcée. Par ailleurs les neurones du striatum GABAergiques exercent par un système de collatérales une inhibition sur d'autres neurones du striatum dans le contrôle d'autres mouvements, par exemple l'extension et la rotation de l'articulation.
4. Les conséquences de la destruction des neurones à dopamine de la substance noire
Le modèle de fonctionnement des noyaux de la base permet d'expliquer la triade de symptômes moteurs que présentent les parkinsoniens. L'akinésie, la rigidité musculaire et les tremblements sont la conséquence d'une lésion de la substance noire, à savoir une raréfaction des neurones dopaminergiques au sein de la pars compacta. Ainsi la boucle nigro-striée n'active plus aussi efficacement la voie directe (B) et/ou ne freine plus la voie indirecte (B') ; il en résulte une inhibition excessive de l'activité thalamo-corticale qui explique l'akinésie parkinsonienne. La rigidité serait le fait d'une tension musculaire excessive car le relâchement des muscles antagonistes n'est pas suffisant. Les tremblements trouvent leur origine dans la dépolarisation des neurones du striatum à acétylcholine qui déchargent en bouffées rythmées à la fréquence du tremblement quand il y a une carence en dopamine (enregistrements effectués chez l'animal après lésion de la substance noire pars compacta).
Si le rôle des noyaux gris centraux est largement établi en ce qui concerne la fonction motrice, on a également pu montrer que parallèlement, une partie des noyaux gris centraux participe au contrôle des aspects cognitifs et émotionnels du comportement. On comprend alors que les patients souffrant de la maladie de Parkinson présentent des déficits cognitifs spécifiques qui concernent principalement la vitesse de traitement des informations visuo-spatiales, l'attention et les fonctions exécutives. Ces déficits sont de plus en plus marqués au cours de l'évolution de la maladie et l'atteinte des régions limbiques et du néocortex est à l'origine de démence.
La recherche n'a pas encore permis de comprendre comment naît la commande du mouvement au niveau du cortex ; on connaît cependant l'ensemble des structures impliquées et la nature des neurotransmetteurs libérés. On peut considérer que la réalisation d'un mouvement est la résultante du fonctionnement d'un circuit neuronique particulier. Chez le patient parkinsonien, un maillon de la chaîne neuronique commence à ne plus fonctionner aussi bien ce qui introduit une certaine disharmonie dans le mouvement et des effets en cascade que la thérapie tente de minimiser.
Ainsi l'électrostimulation du pallidum interne et du noyau subthalamique permet d'améliorer les troubles moteurs des parkinsoniens. Le noyau subthalamique réglant le niveau d'activité des structures de sortie des ganglions de la base, sa stimulation permet de court-circuiter les dommages liés à la disparition des neurones à dopamine.