Le multigénisme dans le cancer du sein, avec prépondérance de gène
|
Origines de la prédisposition héréditaire au cancer du sein |
|
|
Gène |
Contribution au cancer du sein d'origine héréditaire |
|
BRCA 1 |
20 à 40 % |
|
BRCA 2 |
10 à 30 % |
|
TP 53 |
< 1 % (association avec le syndrome de Li-Fraumeni) |
|
PTEN |
< 1% (association avec le syndrome de Cowden) |
|
Gènes encore non découverts |
30 à 70 % |
|
ASCO Curriculum: Cancer Genetics and Cancer Predisposition Testing American Society of Clinical Oncology. Alexandria VA; 1998 |
|
Le groupe des gènes BRCA
Il y a deux gènes connus dans le groupe de ces gènes : BRCA1 et BRCA2. Ils ont été découverts en 1994 et 1995.
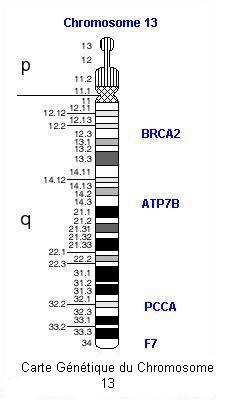
Ces deux gènes sont localisés sur les chromosomes 17 et 13 respectivement. Les hommes et les femmes, aussi bien les uns que les autres, peuvent hériter et transmettre cette prédisposition génétique autosomale dominante au cancer du sein.
Il est rare que les hommes expriment ce gène, mais ils peuvent être des vecteurs du gène altéré, à l'égard de leurs fils et de leurs filles. Quand l'un des parents est porteur d'une prédisposition génétique autosomale dominante, chaque enfant a 50% de chances d'en hériter.
Chaque personne porteuse d'une prédisposition génétique ne développera pas obligatoirement le cancer correspondant mais son risque sera fortement augmenté par rapport à la population générale. Les études épidémiologiques indiquent qu'une femme porteuse d'une mutation de BRCA1 présente un risque de cancer du sein au cours de sa vie (risque cumulatif) de 50 à 85% (mais d'autres études avancent une valeur plus faible) et cette pathologie pourra survenir très tôt. Pour le gène BRCA2 le risque de cancer du sein est de 50 à 85% et certaines études indiquent que la survenue du cancer est dans ce cas plus tardive qu'avec une mutation de BRCA1.
 |
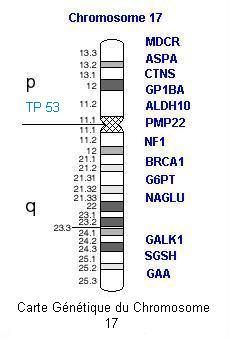 |
| Carte des deux chromosomes porteurs des mutations reconnues pour leur rôle dans la prédisposition aux cancers du sein, avec notamment le gène BRCA1 sur le chromosome 17 et BRCA2 sur le chromosome 13 |
|
Les rôles de chacun de ces deux gènes sont encore mal connu.
- BRCA1 est un grand gène d'environ 100 kilobases, codant pour une protéine de 1863 acides aminés. La protéine pour laquelle code le gène BRCA1 semble être un gène suppresseur de tumeur, ayant un rôle dans la stabilité génomique.
Dans 85% des cas de mutation, la protéine BRCA1 est profondément modifiée voire absente. Les autres mutations de la protéine BRCA1 sont des mutations faux-sens.
- BRCA2 est aussi un grand gène, sa séquence codante est deux fois plus importante que celle de BRCA1. On ne connaît toutefois pas de protéine correspondant à cette séquence de BRCA2.
Un grand nombre de mutations peuvent affecter BRCA1: environ 500, et elles sont réparties tout le long du gène; de même pour BRCA2: environ 300 mutations qui sont, elles aussi, réparties sur toute la longueur du gène. Si bien que l'identification d'une mutation dans une famille où le cancer du sein et/ou de l'ovaire semble héréditaire, est difficile et lourde. En effet il faut rechercher chacune de toutes les mutations possibles pour chacun des deux gènes, pour pouvoir affirmer l'origine génétique des cas de cancers de la famille. Après la première identification, les dépistages au sein de la famille sont plus simples car la modification génique précédemment identifiée est la seule à être recherchée.
Le multigénisme en présence de BRCA
1.Le gène TP53
Le gène TP53 est localisé sur le chromosome 17p (voir carte chromosomique ci-dessus). Les mutations germinales du gène TP53 sont dominantes. La pénétrance de ces mutations est de 50% à 50 ans. Ce gène code pour une phosphoprotéine nucléaire de 53kd. Elle a deux rôles principaux : régulateur négatif de la croissance et de la prolifération cellulaire ; réparation des altérations de l'ADN. En cas de modification de la molécule d'ADN, la protéine p53 arrête le cycle cellulaire en phase G1, permettant aux mécanismes de réparations de l'ADN de se mettre en oeuvre avant la duplication de ce dernier. La protéine p53 est aussi un acteur de la mort cellulaire programmée. Une inactivation du gène TP53 permettrait le maintien des modifications de l'ADN et de ce fait un développement à terme, de cellules malignes.
|
Le cycle cellulaire a été découpé en plusieurs phases : deux phases de maintien quantitatif du matériel chromosomique, G1 et G2 et deux phases de modification quantitative de ce matériel, S ou duplication de l'ADN et M ou mitose. |
Les différentes phases du cycle se succédent au cours du temps, mais à deux moments, en G1 et à la limite entre G2 et M, ce cycle peut être stoppé ou poursuivi. |
Le gène TP53 serait impliqué dans au moins 1% des cas de cancers du sein survenant avant 35 ans. Bien que les mutations germinales du gène TP53 soient présentes dans toutes les cellules somatiques, les tumeurs malignes, dont les mutations sont la cause, ne sont présentes que dans les cellules de certains organes, les cellules cibles. Des analyses de tumeurs réalisées dans 91 familles depuis 1990, caractérisées par une ou plusieurs mutations germinales de TP53, montrent que le cancer du sein est la plus fréquente conséquence (24%) d'une telle mutation. Les mutations de la lignée TP53 augmente de façon général le risque de cancer et plus fortement le risque de cancer du sein. L'ensemble des problèmes causés par ces mutations a été appelé le syndrome de Li-Fraumeni.
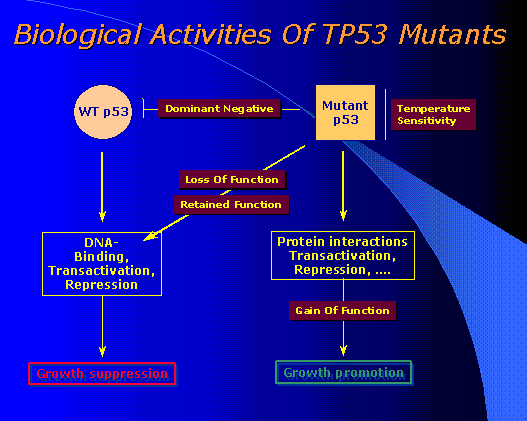 |
|
Quelques activités des allèles mutants du gène TP53 WT= Wild Type L'allèle sauvage WT du gène TP 53 permet la réparation de l'ADN avec arrêt de croissance
cellulaire. L'allèle mutant du gène TP 53 est sensible à la température. Il a des fonctions de stimulation de la croissance cellulaire. Les fonctions de l'allèle sauvage peuvent être restaurées à partir de la mutation, il y a alors retour au fonctionnement de l'allèle sauvage. |
2. Le gène PTEN
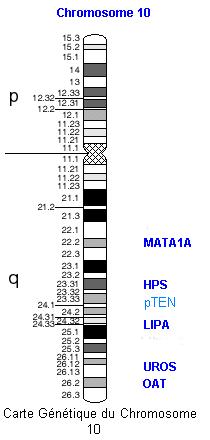
Un autre syndrome rare peut être responsable d'une augmentation du risque de développer un cancer du sein, c'est le syndrome de Cowden, correspondant aux mutations du gène PTEN sur le chromosome 10 (voir carte ci-dessous), gène suppresseur de tumeur intervenant dans la régulation de la croissance cellulaire. Il s'agit aussi de mutations dominantes. Les atteintes concernent la peau, les seins, la thyroïde, le tube digestif, peut-être l'utérus.
3. Le gène ATM
En 1999, une équipe américaine a mis en évidence une interaction entre deux gènes de l'organisme dont les mutations simultanées pourraient être à l'origine de 10% de tous les cancers du sein. Ces deux gènes sont BRCA1 et ATM. Le gène ATM est localisé sur le chromosome 11q22-23 (voir carte ci-dessous), il a été caractérisé en 1995. Ses rôles sont divers : il participe aussi bien au contrôle du cycle cellulaire (G1 et G2), à la réparation des cassures double-brins, à la recombinaison au cours de la méiose, qu'à la maturation des gènes d'immunoglobulines. La portion codante est grande : 12 000 paires de bases.
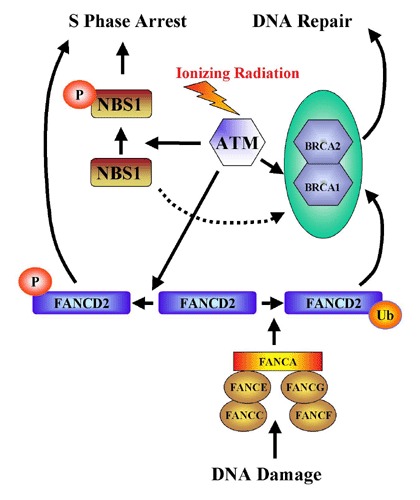
C'est au niveau de la réparation des cassures double brin de l'ADN qu'il y a interaction entre les deux gènes : un des produits du gène ATM est responsable de la phosphorylation de la protéine BRCA1, nécessaire à la réparation des cassures dans les doubles brins d’ADN après action de radiations ionisantes, comme le montre le document suivant :
|
Inter-relations entre gènes favorisant le cancer du sein |
|
L'association BRCA1 / BRCA2 / Protéine FancD2 modifiée (BRCA1 et BRCA2 sont associés dans le noyau coloré en turquoise dans le diagramme) conduit à l'activation des processus de réparation de l'ADN. La protéine kinase ATM peut être activée par des radiations ionisantes ainsi que d'autres cibles. L'une de celles-ci, la protéine FancD2 est phosphorylée par l'ATM ce qui conduit à l'arrêt de la phase S de la division cellulaire. La phosphorylation, par l'ATM, de la protéine codée par les gènes NBS1 du syndrome Nijmegen Breakage et BRCA1 est un évènement supplémentaire de cette voie métabolique. La protéine NBS1 est intégrée dans un complexe, qui, lui aussi, permet la phosphorylation de FancD2 par ATM. NBS1 apparaît comme ayant deux fonctions indépendantes, l'une correspondant à l'induction de l'arrêt de la phase S quand FancD2 n'est pas sollicitée et l'autre correspondant à l'interaction avec FancD2 pour le déclenchement de la réparation de l'ADN (flèches du diagramme). Ainsi FancD2 est à l'intersection de deux voies métaboliques : l'une conduisant à l'arrêt de la divison cellulaire en phase S avec intervention de ATM par l'intermédiaire de NBS1 et des protéines associées, l'autre en réponse à un dégât de l'ADN par l'intermédiaire du complexe de Fanconi. Le gène BRCA2 a été reconnu comme étant l'ensemble des deux gènes FancB et FancD1. Ces deux derniers gènes et les gènes FancA, FancC, FancE, FancF et FancG sont responsables de l'anémie de Fanconi. C'est une maladie congénitale affectant les éléments de la moelle osseuse, ayant pour conséquence une anémie, une leucopénie et une thrombocytopénie, associée à des malformations cardiaques, rénales et des membres ainsi qu’aux modifications pigmentaires du derme. La rupture chromosomique spontanée et la prédisposition à la leucémie sont des traits caractéristiques de cette maladie. Huit groupes complémentaires sont impliqués dans l'anémie de Fanconi (A, B, C, D1, D2, E, F, et G) parmi lesquels sept ont un gène identifié. Cinq des gènes de l'anémie de Fanconi (FancA, FancC, FancE, FancF, et FancG) forment un complexe qui interagit avec l'ADN et modifie la protéine FancD2. |
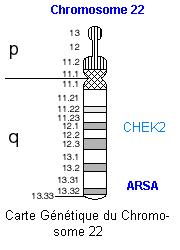
4. Le gène CHEK2
Le gène CHEK2 est un suppresseur de tumeur (voir carte ci-dessous). Il participe donc à la régulation du cycle cellulaire. La protéine CHEK2 est activée quand des dégâts sont causés à la molécule d'ADN, que ce soit par des radiations ionisantes, par des produits chimiques ou sous forme de cassures double brin au cours des échanges chromosomiques. Cette protéine interagit avec d'autres molécules : l'une codée par un gène suppresseur de tumeur, la protéine p53, pour arrêter le cycle cellulaire en cas de dommages à l'ADN ; l'autre, la protéine codée par BRCA1. L'ensemble de ces protéines commandent soit le déclenchement de la mort cellulaire programmée, soit les réparations de l'ADN. Une mutation du gène CHEK2 peut entraîner une légère augmentation du risque de cancer du sein.
De nouvelles études permettent de compléter le schéma fonctionnel (vu ci-dessus) des interactions moléculaires à l'origine de la cancérisation des cellules mammaires. En effet la protéine kinase ATM active elle-même les deux gènes CHEK2 et TP53, si bien que les deux protéines codées par ces deux gènes permettent l'arrêt de la division cellulaire grâce à la phosphorylation de la protéine p53 par la protéine CHEK2, à la suite d'un dommage à la molécule d'ADN. Lorsque le gène ATM est muté et devient inactif, la cascade des réactions chimiques CHEK2 / p53 d'une part et FancD2 / NBS1 / BRCA1 / BRCA2 d'autre part se fait moins bien et la cancérisation devient possible.
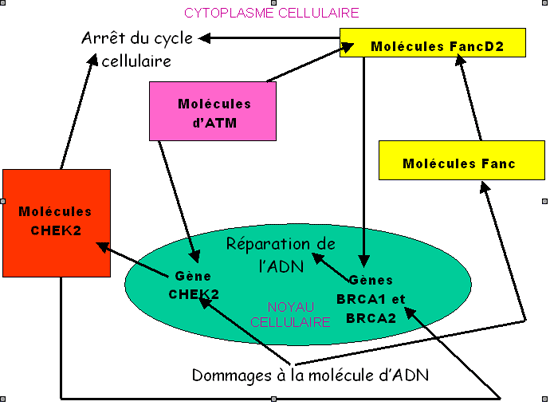 |
| Dans ce diagramme le noyau cellulaire est coloré en turquoise, les molécules des rectangles colorés sont des protéines. Le détail des interactions mettant en jeu les protéines de l'anémie de Fanconi n'est pas redonné. La molécule ATM apparaît comme jouant un rôle pivot grâce à la stimulation de la phosphorylation de la molécule FancD2, de la molécule NBS1 (non représentée ici) et à la stimulation des deux gènes TP53 et CHEK2. |