Activité Mutation somatique et mutation germinale P53 (classe de 2de)
Démarche proposée par Jean-Claude Hervé, IA-IPR, Versailles
Objectif de l'activité
L'objectif principal de ce point du programme est de montrer la différence entre les conséquences d'une mutation somatique et d'une mutation germinale. Le cancer fourni des exemples parlants, montrant en particulier l'interaction entre génotype et environnement, interaction qui est sous-jacente à l'ensemble du fonctionnement de l'organisme. Ni le polymorphisme des gènes impliqués, ni les modes de transmission du cancer ne sont ici visés.
Approche de la notion de mutation à partir des cellules cancéreuses et non cancéreuses (exemple P53)
Les données sur le P53 doivent permettre d'illustrer l'importance des mutations chez les organismes pluricellulaires. Le support choisi est celui des cellules cancéreuses au sein d'un organisme.
Une réflexion sur le cancer doit attirer l'attention sur le fait que les cellules cancéreuses ont un phénotype différent des autres cellules de l'organisme (division anarchique ne répondant pas aux signaux de régulation de l'organisme) et que ce phénotype est héréditaire. Cela conduit à supposer que les cellules cancéreuses ont un génotype différent des autres cellules de l'organisme.
La comparaison des allèles du gène P53 (avec le logiciel Anagène) des cellules cancéreuses et non cancéreuses d'un organisme présentant un cas de cancer dû à une mutation somatique (cancer oesophage, cancer du foie), conduit à découvrir que les cellules cancéreuses ont deux allèles de P53 différents, l'un de ces allèles étant semblable aux deux allèles identiques trouvés dans les cellules non cancéreuses.
A partir des connaissances acquises sur les mutations chez les levures, l'élève peut proposer une explication sur l'origine du génotype P53 des cellules cancéreuses, ce qui doit conduire à la notion de mutation somatique.
D'autre part, la comparaison des allèles du gène P53 (avec le logiciel Anagène) dans les cellules cancéreuses et non cancéreuses d'un organisme, dans différents cas de cancers (cancers du foie, de l'oesophage, syndrome de LiFraumeni) conduit à découvrir que dans certains cas seules les cellules cancéreuses possèdent un allèle muté du gène P53 (il y a donc mutation somatique, comme dans le cas des cancers du foie et de l'oesophage), alors que dans d'autres cas, les cellules cancéreuses mais aussi les cellules normales possèdent un allèle muté du gène P53 (il y a donc mutation germinale, comme dans le cas du syndrome de LiFraumeni).
Des informations supplémentaires sur P53 gène suppresseur de tumeurs et sur les mécanismes génétiques à l'origine d'une tumeur (mutations touchant plusieurs gènes) sont utiles pour ne pas associer de façon trop simpliste cancer et mutation du P53.
LA PROTEINE P 53
Rédigé par François Héron, Faculté de médecine, Caen
Le gène p53 est situé en position sur le chromosome 17p13.1 (NCBImapviewer) Le gène a été très conservé pendant l'évolution.
Structure biochimique
La protéine p53 est une phosphoprotéine de 393 acides aminés de poids moléculaire 53 kDa. On la trouve en très petite quantité dans les cellules normales, mais en grande abondance dans les cellules transformées en culture ou dans les tumeurs humaines.
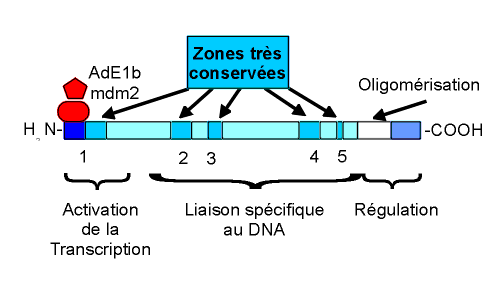 |
Schéma de la structure biochimique de la protéine p53 Les segments indiqués par les flèches sont très conservés tout au long de l’évolution. Dans la région amino-terminale, on note le site de l’activation de la transcription. Il est inhibé:
|
Pour être active, elle doit agir sous forme de tétramère. Aussi, une simple lésion sur une des protéines constitutives suffit à supprimer ou diminuer sa fonction.
La sensibilité à l'atteinte du DNA
Lors d'une agression cellulaire, la concentration et la demi-vie de p53 s'accroissent par une diminution de sa dégradation physiologique. On a montré expérimentalement qu’une simple lésion double brin suffisait à induire une augmentation du taux de p53. De même, un trou d’environ 30 à 40 bases dans la traduction du DNA sur un simple brin suffit également à provoquer cette augmentation et l’arrêt du cycle cellulaire. Un autre mécanisme déclenchant est constitué par un misappariement de bases ou une insertion délétion de bases. Plusieurs mécanismes ont été suggérés pour expliquer l’arrêt de G1 provoqué par la protéine p53. L’activation de la protéine p53 pourrait se faire par une liaison directe avec les lésions du DNA. Une autre mécanisme fait intervenir des protéine kinases activées par le DNA (DNA-PK), qui se fixent sur les liaison du DNA grâce à une protéine spécifique Ku, très conservée à travers l’évolution.
Action de la P 53
Deux rôles particuliers sont dévolus à cette protéine : soit l'arrêt du cycle cellulaire entre la phase G1 et la phase S, soit la mort cellulaire par une phénomène d'apoptose. La protéine p53 se lie avec une séquence spécifique de DNA (c'est donc un facteur de transcription) aboutissant à une interaction avec le cycle cellulaire par l'intermédiaire d'un gène appelé WAF1 / Cip1, (pour Wild Type p53-activated fragment et cdk2 inhibiting protein) dont la protéine p21 se lie aux kinases cdk2, et inhibe leur activité.
La cellule s'arrête avant la synthèse du DNA et peut réparer d'éventuels dommages. De nombreux stimuli provoquent l'augmentation de la p53, notamment l'irradiation par les rayons X ou gamma. Dans d'autres cellules, l'augmentation de la protéine p53 induite par l'irradiation provoque l'induction de l'apoptose ou mort programmée, que l'on peut interpréter comme la solution préférentielle pour l'organisme quand la réparation du DNA n'est pas possible.
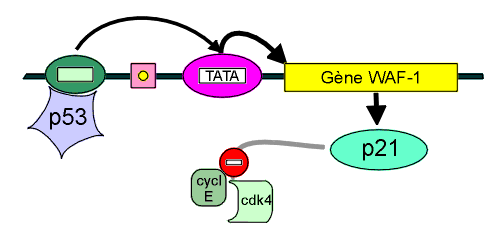 |
Schéma de l’action de la p53 comme facteur de transcription du Gène WAF-1, La p53 est nécessaire à la transcription de la protéine p21. Celle-ci inhibe l’action du couple cycline E - cdk4 et empêche ainsi la phosphorylation de la protéine chapeau Rb (cf. plus loin). Il existe aussi une interruption de la formation d’un complexe cycline E cdk2. |
Lors de la radiothérapie ou la chimiothérapie qui attaquent le DNA, les cellules normales possédant la protéine sauvage p53 voient leur cycle cellulaire s'arrêter pour permettre une réparation du DNA (ou au pire une apoptose). Les cellules cancéreuses, qui ne possèdent pas le gène p53 'sauvage', vont progresser dans la synthèse du DNA, malgré l'agression, et aboutir à des cellules de plus en plus anormales qui finissent par mourir.
La protéïne p53, et le cancer
Dans de nombreuses pathologies cancéreuses, on observe des délétions ou des mutations de la protéine p53. Environ 60% des cancers ont une mutation de leur gène p53. Ces mutations sont du type sens inversé ou une homozygotie avec perte de l'allèle sauvage (cancers du colon, du poumon, de l'œsophage, de l'estomac, du foie, du sein, de la vessie). Les mutations ont des localisations particulières à la pathologie cancéreuse mais reflètent aussi le cancérigène concerné (cf. le chapitre sur la cancérogenèse).
Les arbres généalogiques
Ces arbres permettent d'atteindre deux objectifs :
- différencier mutation somatique et mutation germinale,
- sensibilier à l'action de facteurs de l'environnement, ici alimentaires, en tant qu'agents augmentant la fréquence des mutations.
Les connaissances de génétique acquises en troisième suffisent pour l'analyse de ces arbres, à savoir :
- présence au sein de chaque cellule de 2 allèles d'un même gène,
- présence d'un seul allèle de chaque gène dans les gamètes produits par un individu.
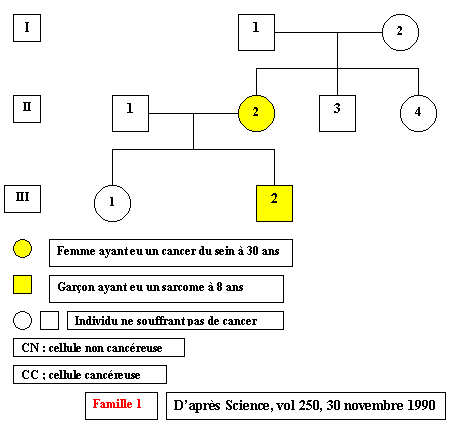
Arbre de la famille 1
(Cliquer sur l'arbre pour identifier le génotype de chaque individu)
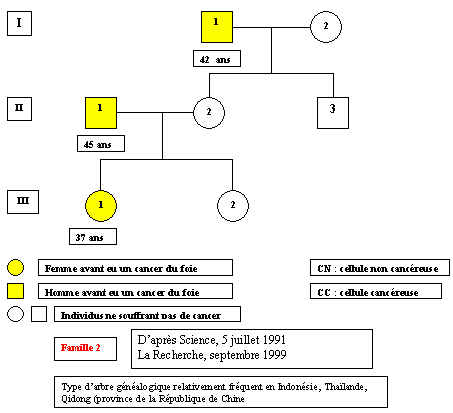
Arbre de la famille 2
(Cliquer sur l'arbre pour identifier le génotype de chaque individu)
Ressources génétiques
- Analyse génétique sur le locus p53 sur la famille 1
- Analyse génétique du locus p53 sur la famille 2
- Variabilité du gène P53 en relation avec sa structure