La thérapie génique par addition de gène thérapeutique
III - La thérapie génique par addition de gène thérapeutique
L’exemple analysé ci-dessous est celui de la thérapie qui a été un succès chez le premier patient traité.
1 - Le patient
C’est un adolescent âgé de 13 ans au moment de la thérapie. Sa drépanocytose a été diagnostiquée durant sa première année. Durant son enfance, il a subi plusieurs crises vaso-occlusives très douloureuses. Le traitement classique par l’hydroyurée est devenu assez peu efficace. A 9 ans il était anémié par suite de la mort précoce des hématies, de sorte qu’un programme de transfusions sanguines a alors été instauré. Les symptômes de sa drépanocytose étaient donc sévères. Il n’y avait pas dans sa famille de donneur compatible (voir DICS-X) pour une greffe de cellules souches « saines » d’un donneur. Un essai de thérapie génique était la seule solution pour espérer une guérison et il a été réalisé avec le consentement de l’adolescent et de ses parents.
2 - Le vecteur du transfert du gène thérapeutique dans les cellules souches
Pour transférer le gène thérapeutique dans les CSH, les médecins ayant réalisé cette thérapie ont utilisé un vecteur lentiviral dérivé d’un lentivirus, le VIH. Les lentivirus sont des rétrovirus dont ils possèdent les propriétés fondamentales : un génome en ARN avec un gène Env qui leur permet de pénétrer dans une cellule cible, et un gène Pol qui code pour deux enzymes, la transcriptase inverse et l’intégrase qui leur permet d’insérer leur génome et donc celui du gène thérapeutique dans celui de la cellule cible. Le vecteur lentiviral utilisé dans cette thérapie génique de la drépanocytose dérivé du VIH est bien sûr dépourvu des éléments indispensables à la production de virions VIH.
Les données de base sur rétrovirus et vecteur rétroviral sont développées dans le dossier sur la thérapie génique du DICS-X.
Contrairement aux vecteurs rétroviraux gamma utilisés en premier dans les thérapies géniques, les vecteurs lentiviraux sont capables d’introduire leur génome non seulement dans les cellules en division mais aussi dans les cellules quiescentes. Le risque de mutation insertionnelle conduisant à des cellules cancéreuses est réduit mais non nul. L’efficacité de la transduction des cellules souches par le vecteur lentiviral est nettement supérieure à celle assurée par les vecteurs rétroviraux simples.
3 - Le gène thérapeutique transféré dans les CSH par le vecteur lentiviral
Le dossier sur la thérapie génique du DICS-X renseigne sur le principe de la construction d’un vecteur rétroviral donc sur l’intégration du gène thérapeutique dans le génome du vecteur. Ce paragraphe aborde seulement les caractéristiques du gène thérapeutique inséré dans les CSH qui s’ajoute au génome de ces cellules et s’y exprime.
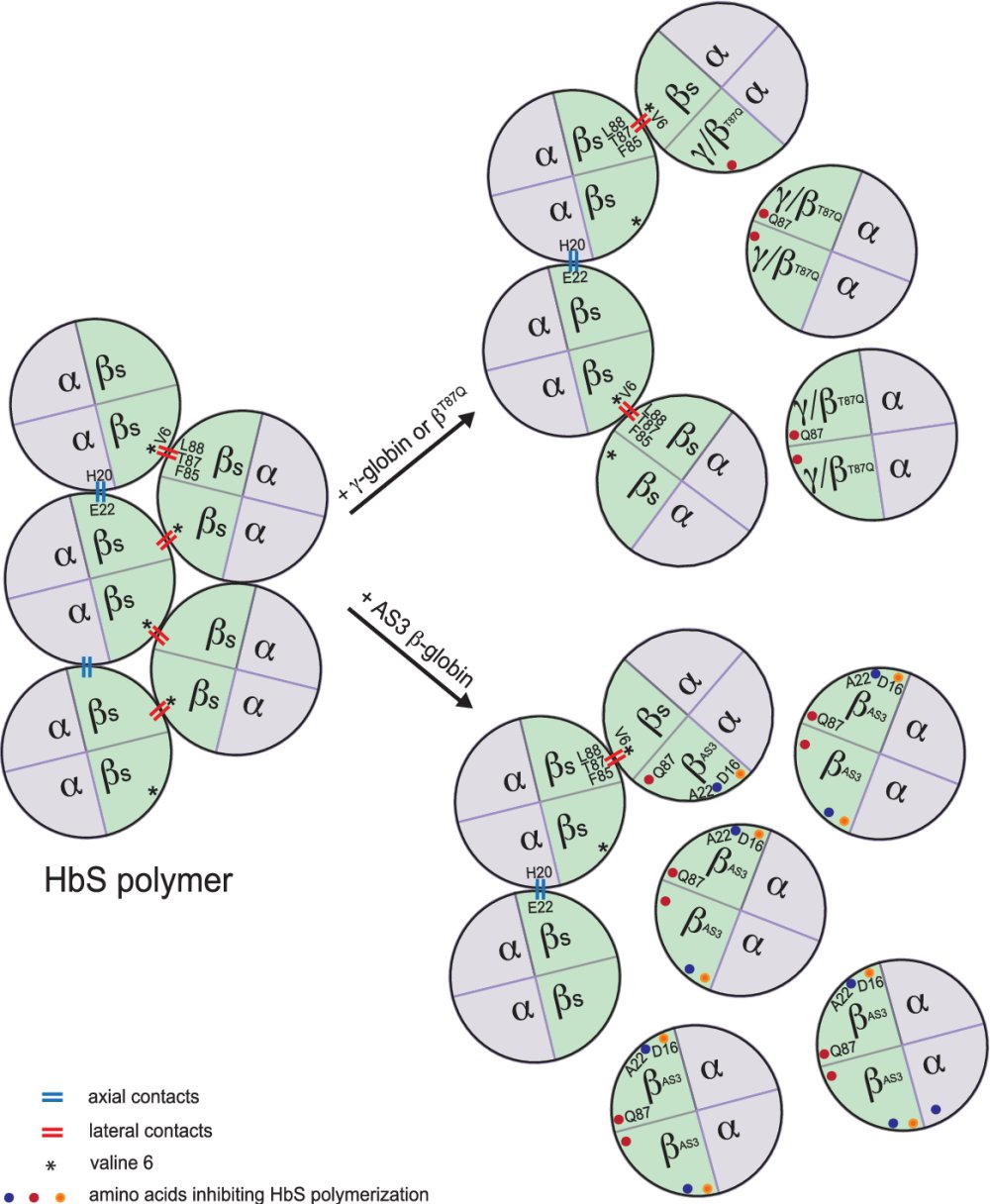
Il s’agit d’un allèle du gène qui code pour la chaîne bêta de l’hémoglobine mais qui diffère de l’allèle « sauvage » par une mutation ponctuelle au codon 87. C’est une substitution qui fait qu’au niveau de la chaîne bêta de l’hémoglobine, l’acide aminé glutamine remplace l’acide aminé thréonine (T87Q). La chaîne polypeptidique gamma de l’hémoglobine foetale possède aussi en position 87 la glutamine qui contribue à l’inhibition de la polymérisation de l’hémoglobine HbS. En s’exprimant dans les cellules qui synthétisent de l’hémoglobine, cet allèle thérapeutique va produire des chaînes bêta A T87Q qui devraient s’opposer à la falciformation.
Fichier des séquences : Thérapies drépanocytose.edi
(Contient les séquences de l'hémoglobine foetale Gamma G, les hémoglobines beta normale et drépanocytaire, les deux séquences des gènes thérapeutiques).
4 - Les résultats de la thérapie 15 mois après sa réalisation
a. Taux de globules rouges falciformes (déformés, en forme de faucille)
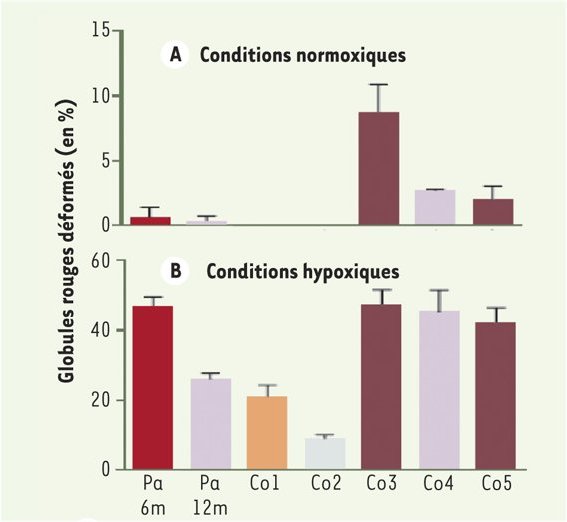
Pa : patient 6 mois et 12 mois après la thérapie
CO1 : témoin hétérozygote HbA//HbS (mère du patient)
CO2 : témoin hétérozygote
CO3 ; CO4 ; CO5 : Patients drépanocytaires
b. Evolution de la concentration des molécules d’hémoglobine durant les 15 mois après la thérapie
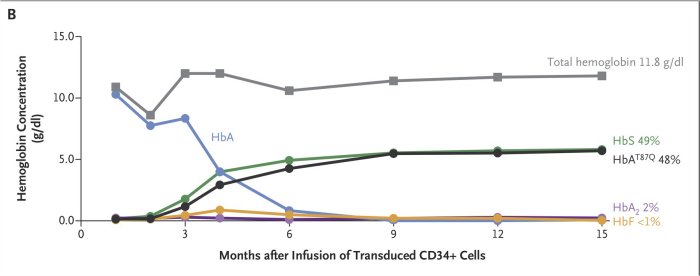
Les molécules d’hémoglobine A proviennent des perfusions de globules rouges reçus par le patient avant la thérapie génique et après la thérapie. La dernière transfusion a eu lieu 88 jours après la thérapie.
c. Bilan de ces données biologiques
L’évolution des concentrations d’hémoglobine indique qu’au moment de la réalisation de la thérapie, toute l’hémoglobine du patient est de l’hémoglobine HbA provenant des perfusions de globules rouges reçues. Il ne produit pas de globules rouges, et donc d’hémoglobine, suite au traitement d’ablation de la moelle osseuse reçu durant les jours qui ont précédé la thérapie. La concentration d’hémoglobine HbA diminue ensuite constamment car la durée de vie d’un globule rouge est d’environ 120 jours. La moelle osseuse du patient commence à produire de l’hémoglobine HbS et HbA T87Q (hémoglobine thérapeutique) 3 mois environ après la thérapie, et cette production augmente jusqu’à 9 mois et reste stable par la suite. La production de globules rouges et donc d’hémoglobine est assurée à partir de 6 mois par les cellules issues des CSH transductées. Cela traduit l’efficacité de la thérapie. La quantité globale d’hémoglobine à 15 mois de 11,8 g/dl est une valeur normale. Les quantités des molécules de HbS et de HbA T87Q sont à peu près équivalentes : c’est une situation qu’on retrouve chez les hétérozygotes avec les tétramères HbS et HbA. Cela renforce la conclusion sur l’efficacité de la thérapie.
Les histogrammes sur le pourcentage d’hématies falciformes montrent :
- Que le phénotype « hématie en faucille » chez les patients drépanocytaires est nettement plus important en conditions hypoxiques donc lorsque les molécules d’hémoglobine sont sous la forme désoxyhémoglbine.
- Que 12 mois après la thérapie le pourcentage d’hématies en faucille chez le patient traité en conditions hypoxiques est nettement inférieur à ce qu’il était avant la thérapie et inférieur à celui des 3 autres patients drépanocytaires non traités (Co3 ; Co4 et Co5). C’est une confirmation de l’inhibition de la polymérisation de l’hémoglobine HbS exercée par la protéine résultant de l’expression du gène thérapeutique.
d. Données cliniques 15 mois après la thérapie
Quinze mois après la greffe des CSH dont le génome a été modifié par addition d’un gène thérapeutique, le patient n’a plus besoin d’être transfusé, ne souffre pas de crises vaso-occlusives et a repris ses activités physiques et scolaires. L’évolution des paramètres biologiques se traduit par une amélioration nette des symptômes cliniques de la maladie.
e. Nécessité d’autres essais cliniques et d’évolution des protocoles
L’évaluation de cette thérapie génique par addition d’un gène thérapeutique doit être poursuivie sur un plus grand nombre de patients et étudiée sur le long terme pour s’assurer de la stabilité de la production des CSH modifiées et de l’absence d’effets inverses.
Les médecins s’efforcent d’introduire des nouveautés aux différentes étapes de la thérapie afin d’augmenter son efficacité et d’améliorer sa sureté. Par exemple, la figure indique une évolution dans la séquence du gène thérapeutique. Désigné AS3 le gène code pour une protéine bêta possédant la mutation T87Q mais aussi une mutation en position 22 où l’acide glutamique remplacé par l’acide aminé alanine, ce qui rompt les contacts axiaux entre les tétramères. En outre la glycine en position 16 est remplacée par l’acide aspartique ce qui rend la protéine transgénique plus compétitive pour se lier aux protéines alpha que ne l’est la protéine HbS. Les médecins chercheurs visent ainsi à une optimisation de la stratégie de thérapie génique par addition de gène.
f. Evolution dans la thérapie par addition de la drépanocytose.