Des recherches en cours sur la thérapie génique
Des recherches en cours sur la thérapie génique
Les thérapies protéiques ont représenté un progrès majeur dans le traitement de la mucoviscidose. Néanmoins, ses limites ont incité plusieurs équipes de chercheurs à travailler sur de nouveaux protocoles de thérapie génique. Celle-ci présente deux avantages : si elle est efficace, elle peut s’appliquer à tous les patients quelles que soient les mutations du gène CFTR ; elle n’impose pas les contraintes journalières des thérapies protéiques. Elle peut aboutir à la guérison.
- Thérapie génique par addition d’un gène thérapeutique CFTR sain
Cette thérapie a pour objectif de transférer un gène « CFTR » dans les cellules épithéliales pulmonaires, dans l’espoir d’obtenir l’expression de ce gène thérapeutique dans ces cellules et donc le rétablissement de protéines CFTR fonctionnelles dans leurs membranes apicales.
Les résultats les plus récents ont été publiés en 2015 par une équipe de chercheurs britanniques dirigée par le professeur Alton. Comme pour toutes les thérapies de ce type, ils ont utilisé un vecteur pour transférer le gène thérapeutique. Mais ce vecteur n’est pas viral mais est un liposome dénommé GL67A. Ce liposome est une vésicule lipidique dans laquelle est encapsulé un plasmide GM169. Dans la séquence de ce dernier est insérée la séquence ADNc du gène CFTR. Les caractéristiques du liposome font qu’il introduit le plasmide dans les cellules épithéliales cibles.
L’essai clinique a été réalisé en double aveugle sur 136 patients âgés de 12 ans et plus dont le VEMS était compris entre 50 et 90%. Ils ont été répartis en deux groupes (même VEMS moyen de chaque groupe : 70%). Le premier du 12 juin 2012 au 24 juin 2023 a reçu un traitement tous les 28 jours consistant en une nébulisation de vecteurs thérapeutiques pGM169/GL67A. Suivant le même protocole, le second groupe a été traité avec un placebo. Pendant l’essai les patients des deux groupes ont reçu les mêmes traitements symptomatiques. Les résultats de cet essai clinique évalués par l’évolution du VEMS des patients sont les suivants (Figure extraite de The Lancet Respiratory Medicine. 2015 Sep 3. Alton et alii. « Repeated nebulisation of non-viral CFTR gene therapy in patients with cystic fibrosis »).
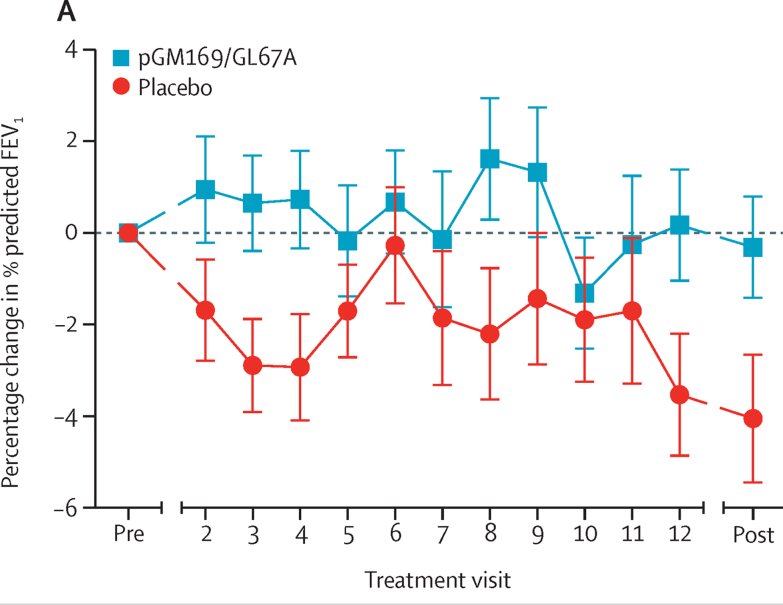
Cette figure indique l’évolution du VEMS moyen de chaque groupe durant les 12 mois de l’essai clinique. Ce sont les différences par rapport à la valeur initiale du VEMS qui sont indiquées. Les deux groupes (thérapie génique et placebo) ont initialement le même VEMS.
A la fin de l’essai, le VEMS moyen du groupe ayant reçu le traitement thérapeutique est le même que 12 mois avant. Cela indique que la thérapie génique n’a pas amélioré la fonction respiratoire. Le VEMS moyen du groupe placebo est de 4% environ inférieur à ce qu’il était initialement ce qui traduit un déclin de la fonction respiratoire. La différence entre les deux groupes permet de conclure que la thérapie génique a stabilisé la fonction respiratoire des patients. les auteurs de cette thérapie considèrent ces résultats comme encourageants.
Durant les 12 mois de l’essai, les patients n’ont pas eu d’effets nocifs secondaires dus au traitement thérapeutique. C’est un point positif mais l’impact sur la fonction respiratoire est trop modeste pour que ce protocole de thérapie génique reçoive l’aval des autorités de santé.
Par la suite, plusieurs équipes de chercheurs ont conçu de protocoles avec de nouveaux vecteurs viraux, notamment lentiviraux. Ces vecteurs ont pour objectif de faciliter le transfert du gène thérapeutique dans les cellules épithéliales pulmonaires et d’augmenter l’intensité et la durée de son expression, mais actuellement (2024) aucun résultat d’essai clinique n’a été publié.
En conclusion, des progrès ont été réalisés dans la livraison de gènes thérapeutiques CFTR dans les cellules épithéliales pulmonaires des patients. Cependant aucun protocole n’a permis d’assurer la production de protéines CFTR fonctionnelles en quantité suffisante pour avoir un effet clinique important faisant penser à la guérison de la maladie, du moins en ce qui concerne la fonction pulmonaire.
- Thérapie génique par édition du génome
Depuis la fin des années 2010, plusieurs équipes de chercheurs se sont orientées vers une autre modalité de la thérapie génique : la technique par édition du génome. Il ne s’agit plus de transférer un gène thérapeutique mais de corriger la mutation du gène CFTR au sein des cellules épithéliales pulmonaires, en particulier des cellules souches. L’expression du gène réparé conduira à la production de protéines CFTR fonctionnelles. Et on peut parler de guérison de la maladie. Plusieurs protocoles ont été conçus dont le plus utilisé fait intervenir le système CRISPR-Cas9.
La description et les fonctions des composants de ce système sont décrites dans le dossier sur la maladie de Steinert : « Principe d’une thérapie génique utilisant le système CRISPR-Cas9 ».
Dans la quatrième partie du dossier sur la drépanocytose, on trouve aussi un résumé sur la description et les fonctions du système CRISPR-Cas9. Il est accompagné d’une figure intitulée « Retouche génomique » reprise ci-dessous.
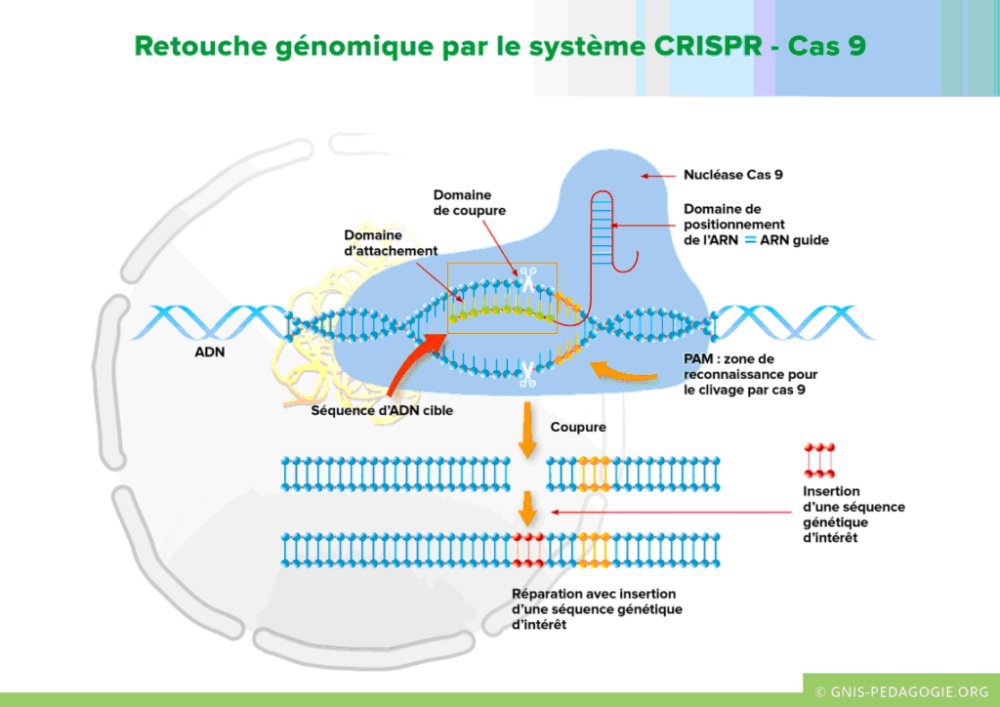
La figure montre l’action du système dans le noyau d’une cellule sur une séquence nucléotidique. Il provoque une cassure double brin en un endroit précis de la séquence. Suite à cette coupure on peut insérer une séquence nucléotidique d’intérêt et ainsi modifier la séquence initiale.
Des expériences reposant sur ce modèle ont été réalisées au cours de recherches sur l’édition génomique dans le cas de la mucoviscidose, notamment dans le cas où l’allèle muté possède la mutation Phe508del. Grâce au guide ARN, l’enzyme cas 9 qui est une nucléase réalise une coupure spécifique double brin, donc au niveau de la délétion du triplet de nucléotides codant pour l’acide aminé 508. Par ailleurs, on fournit aux cellules une séquence nucléique d’intérêt homologue possédant le triplet codant pour la phénylalanine. Grâce au système de réparation de coupure de l’ADN, la séquence d’intérêt réparatrice est intégrée dans celle de l’allèle CFTR.
Les expériences de thérapie par édition du génome ont été réalisées in vitro sur des cultures de cellules épithéliales basales (cellules souches de l’épithélium nasal par exemple) obtenues à partir de patients atteints de mucoviscidose. Elles ont confirmé la possibilité de corriger le gène CFTR. Des équipes ont conçu la possibilité d’utiliser ces cellules génétiquement modifiées en les administrant aux patients dont elles proviennent. C’est une thérapie génique in vivo qui vise à ensemencer les voies respiratoires où les cellules se différencieraient pour reformer un épithélium sain. Ce protocole soulève de nombreuses difficultés et aucun essai clinique n’a été publié.
