Le multigénisme dans le cancer du sein, sans prépondérance de gène
La plupart des cas de cancers du sein non liés aux deux gènes BRCA1 et BRCA2 résultent d'une interaction forte entre l'environnement et le génome.
Les substances cancérogènes de l'environnement ou xénobiotiques (c'est-à-dire des composés ne faisant pas partie des constituants naturels des êtres vivants) sont transformés par l'organisme mais les produits issus de ces tranformations sont parfois plus toxiques que les réactifs. Les réactions chimiques sont catalysées par des enzymes, elles sont donc dépendantes des informations portées par les gènes codant pour ces enzymes. Le schéma suivant montre une chaîne possible de transformations chimiques de détoxication d'un xénobiotique et les types d'enzymes intervenant à chaque niveau (les réactions peuvent se dérouler dans l'ordre indiqué ou pas et il peut exister plusieurs voies simultanées différentes). Les variations interindividuelles dans les réactions de détoxication des substances de l'environnement dépendent aussi de facteurs comme la durée d'exposition aux xénobiotiques ou de l'efficacité des récepteurs de ces substances et de leurs transporteurs transmembranaires, eux-mêmes sous la dépendance d'autres informations génétiques.
| Les phases I et II de détoxication des xénobiotiques faisant intervenir trois types d'enzymes, des mutations des gènes codant pour ces trois catégories de molécules peuvent interagir pour favoriser la formation de précancérogènes. | 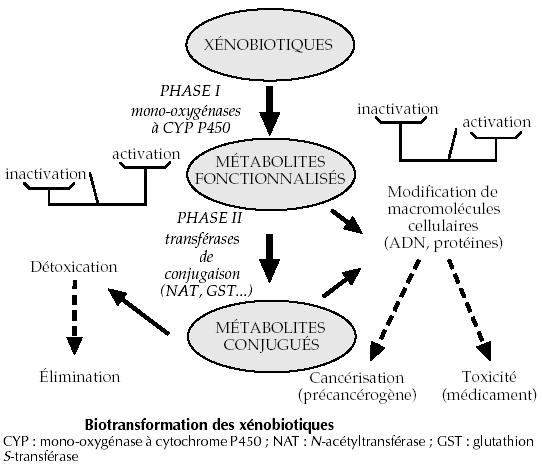 |
Les enzymes de phase I
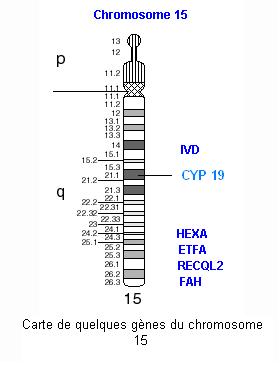
Pour les enzymes de type CYP, il existe plusieurs gènes. Celui qui joue un rôle important dans le cancer du sein est le gène CYP 19. Le gène CYP 19 est celui qui commande la synthèse de l'enzyme cytochrome P450 ou aromatase. Cette dernière est elle-même responsable de la synthèse des oestrogènes à partir des androgènes. La transmission se fait suivant un mode autosomique recessif. Ce gène est localisé sur le chromosome 15.
|
Dans la mesure où une exposition plus longue aux oestrogènes est un facteur de risque accru pour le cancer du sein, le gène muté de l'aromatase serait un candidat plausible pour une diminution de la susceptibilité à ce cancer. Cependant la présence dans certains allèles du gène CYP 19 d'une séquence de quatre nuclétides TTTA répétée (jusqu'à 12 fois) est liée dans la plupart des études épidémiologiques, à une plus grande fréquence de cancer du sein.
Différents gènes interviennent dans la biosynthèse des oestrogènes et peuvent avoir un impact après mutation sur le cancer du sein, CYP19 et aussi CYP17. Les gènes des enzymes du métabolisme des oestrogènes sont capables d'intervenir aussi : CYP1A1, CYP1B1.
Les hormones oestrogènes se fixent sur des récepteurs intranucléaires généralement notés ER. Ainsi l'association de mutations pour les gènes de biosynthèse des oestrogènes et/ou de mutations pour les gènes de leur métabolisme et/ou des récepteurs ER-positifs seraient à l'origine de cancers du sein.
Les enzymes de phase II
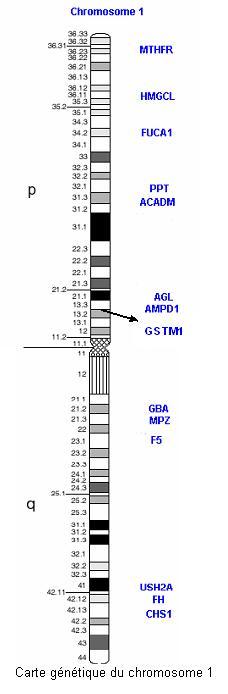
Pour les enzymes de types GST, on connaît plusieurs groupes de gènes : GSTM, GSTP, GSTT, GSTZ. Ceux qui joueraient un rôle dans les cancers du sein seraient GSTM1, GSTP1 principalement. Ces gènes sont portés par les chromosomes 1 et 11 respectivement. Les allèles b et c du gène GSTP1 entraînent une activité fortement réduite de l'enzyme de sorte que la femme porteuse de telle modifications géniques, présente une susceptibilité augmentée aux cancers de la vessie, du poumon et de l'oesophage, en cas d'interaction avec des facteurs environnementaux négatifs. L'absence de l'activité GSTP1 augmente également la susceptibilité cellulaire au dommage de l'ADN par stress oxydant. Pour le gène GSTM1, les études épidémiologiques n'ont pas permis d'observer de différences d'activité enzymatique significative. Certains chercheurs pensent que l'absence de cette activité enzymatique est à l'origine d'une susceptibilité accrue aux différents maladies environnementales induites.
 |
 |
D'autres cas de multigénisme
Le gène HRAS1 ou RAS1 est un oncogène. Dans les cellules normales son activité consiste à donner le signal de la croissance cellulaire quand les récepteurs membranaires cellulaires sont stimulés par une hormone ou un autre agent. Lorsque les récepteurs sont stimulés, le gène HRAS1 donne le signal de la croissance cellulaire, lorsque les récepteurs ne sont pas stimulés, il n'y a pas d'activité génétique de HRAS1 et pas de croisssance cellulaire. Dans un tiers des cancers la mutation de HRAS1 permet un signal positif permanent pour la croissance cellulaire. Cependant la mutation de ce gène n'est pas suffisante pour être responsable, à elle-seule, de la cancérisation d'une cellule. Des interactions avec d'autres gènes sont nécessaires. Le gène HRAS1 est situé sur le chromosome 11.
Le VDR est le récepteur à la vitamine D, il possède aussi un site de fixation à l'ADN, sur le gène cible de la vitamine D. La liaison à l'ADN de la vitamine associée à son récepteur fonctionne comme un déclencheur "off-on" de la transcrition nucléaire. L'action de VDR se situe au niveau du cycle cellulaire. Les cellules sont bloquées en phase G1 et ce blocage aboutit à leur apoptose. La prolifération cellulaire diminue. Certains sites de restriction, soit supplémentaires, soit absents de l'ADN du VDR, seraient à l'origine du polymorphisme de cette phosphoprotéine-récepteur de la vitamine D. Le gène du VDR est sur le chromosome 12.