La vie fixée de la plante: activités pédagogiques pour les terminales S
Travail réalisé par Pascale Naim
ACTIVITES PEDAGOGIQUES autour de l'architecture racinaire (Tales S)
Comment une plante fixée peut-elle s’adapter à une baisse de la disponibilité en eau et nutriments au niveau d’un sol?
Notions / Compétences
|
NOTIONS
|
|
|
COMPETENCES
|
- une germination en rhizotron ou rhizobox deux semaines avant. - un scan ou une photo des résultats. - utiliser un logiciel un logiciel EZ-Rhizo, mesurant les racines.
|
Matériel nécessaire :
- Rhizotron ou rhizobox d’une graine de 8à 15 jours de germination.
- Logiciel EZ-Rhizo, logiciel Open Calc.
- Scanner ou appareil photo, ou images préparées.
- Des images saisies ou scans et des mesures de l’architecture racinaire.
- Tableau de données ou graphiques afin de comparer différentes architectures racinaires.
- Une réponse à la problématique.
ACTIVITE 1: Sélection artificielle des cultures en fonction de l’architecture racinaire.
La sélection des variétés d’orge selon l’architecture du système racinaire, peut-elle permettre l’optimisation de l’absorption des nutriments et de l’eau ?
Les racines sont le point d’entrée naturel des ions et de l’eau dans la plante. Le stress hydrique constitue une cause majeure de perte de rendement, pour tous types de cultures, au sein de divers environnements. Les plantes ont des capacités plus ou moins étendues à tolérer des épisodes climatiques extrêmes. Certaines espèces végétales ou variétés au sein d’une espèce sont capables de continuer à croître et à se reproduire dans des conditions physiques qui s’écartent des moyennes habituelles ; elles font appel à la plasticité de leur génome. D’autres restreignent leur cycle de vie dans une gamme de paramètres moins étendue ; elles sont adaptées à un milieu particulier.
La sélection de plantes cultivées dotées d’une meilleure efficacité, pour l’utilisation des nutriments par leurs racines, est une priorité dans l’agriculture durable, utilisant moins d’intrants
La sélection des variétés selon l’architecture du système racinaire, peut-elle permettre l’optimisation de l’absorption des nutriments et de l’eau ?
Consignes : En utilisant les documents photographiques, des différentes variétés d’orge, vous montrerez que la sélection des variétés par l’homme, a conduit à une amélioration de l’exploration du sol par les racines
Pour cela vous utiliserez judicieusement, les données obtenues par traitement des images par le logiciel EZ-Rhizo.
![]() Attention : il faut respecter des tailles d’images identiques pour le traitement par EZ-rhizo.
Attention : il faut respecter des tailles d’images identiques pour le traitement par EZ-rhizo.
|
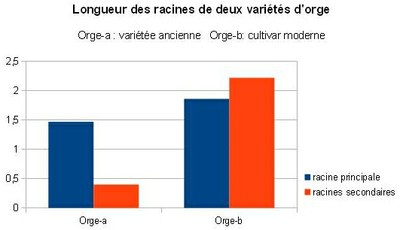
Evolution de l’orge au cours de la domestication et l’élevage |
|
|
A : ancêtre sauvage 6 jours |
 B : cultivar moderne 6 jours
|
Un cultivar est une variété de plante (arbres compris) obtenue en culture, généralement par sélection, pour ses caractéristiques « réputées uniques ».
|
Résultats traités par EZ-Rhizo |
|
 |
 |
|
 |
||||||
|
![]() Il y a nécessité d’une collaboration avec les cultivateurs, pour obtenir un système racinaire idéal pour les différentes cultures et les environnements cibles.
Il y a nécessité d’une collaboration avec les cultivateurs, pour obtenir un système racinaire idéal pour les différentes cultures et les environnements cibles.
Adaptation des racines à la bio-disponibilité des nutriments
ACTIVITE 2: Favoriser les génotypes augmentant le développement des poils absorbants
La capacité des plantes à absorber l'eau et les nutriments minéraux du sol est liée à la capacité de la plante à développer un système racinaire étendu et bien situé. Les radicelles et les poils absorbants peuvent contribuer jusqu'à 67% de l’absorption racinaire. Une méthode simple a été proposée pour évaluer les poils absorbants des racines d'un grand nombre de génotypes de haricot.
Matériels et méthodes
La densité des poils absorbant à été évaluée sur vingt et un génotypes. Des graines de 18 génotypes de haricot en provenance du Brésil ont été utilisées.
- Huit d'entre eux sont des cultivars à haut rendement (Ouro Negro, Diamante Negro, Valente, Talismã, Jalo MG-65, Carnaval-MG, Vi-4899, et Vi-10-2-1)
- Dix sont des génotypes utilisés pour leur résistance aux maladies lors des programmes de sélection (AB 136, Cornell, G 2333, kaboon, México 54, México 309, Pi 207262, TO, TU, VC-4).
|
|
RESULTATS:
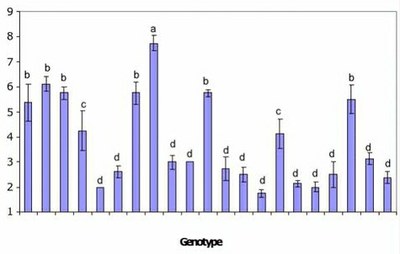
La longueur (en mm) et la densité des poils absorbants (nombre de poils absorbants par mm 2 de surface de la surface de la racine) ont été déterminées pour les racines principales et secondaires.
La Fig. 1 montre la densité des poils absorbants sur les racines secondaires, après 5 jours de germination, et donne une moyenne pour chaque génotype.
ACTIVITE 3 : Adaptations morphologiques du système racinaire à la teneur en phosphates du sol.
La «deuxième révolution verte» sera composée de génotypes avec un rendement supérieur à faible fertilité des sols. L'ONU estime que plus de 1 milliard de personnes sont sous-alimentées, et ce nombre augmente encore.
La production agricole dans les pays en développement est principalement limitée par la sécheresse et la faible fertilité des sols.
L'utilisation d'engrais dans ces régions est faible et n'est pas susceptible d'augmenter considérablement dans un avenir proche en raison de la hausse de leurs coûts.
Les perspectives d’une meilleure irrigation sont limitées par la diminution des disponibilités en eau potable, et les modèles climatiques prévoient encore une demande accrue en eau des cultures à l'avenir.
Le développement des cultures avec une meilleure croissance sous contrainte d’eau et de disponibilité des nutriments est donc un axe très prometteur de la recherche.
Parmi les nutriments, le phosphore a été un axe principal de la recherche et plusieurs caractéristiques de plantes nouvelles ont été détectées, pour améliorer l'exploration du sol et l'acquisition du phosphore.
Les travaux ont abouti à la création de nouveaux génotypes de haricot et de soja avec un rendement nettement meilleur dans les sols pauvres en phosphore. Des projets sont en cours avec le maïs, le haricot et le riz.
Comment les racines d’une plante fixée s’adaptent-elles à une baisse de la disponibilité en phosphates au niveau d’un sol ?
Situation déclenchante :
Le phosphore est un élément indispensable à la vie. Chez les végétaux, le phosphore est prélevé dans le sol par les racines, essentiellement à partir d’ions phosphates PO43- en solution dans l’eau du sol. Or il s’avère que plus le sol est profond, moins il y a de phosphates disponibles.
Vous montrerez comment le pois modifie son architecture racinaire en fonction de la disponibilité en phosphates dans le sol. Votre réponse sera accompagnée d’un tableau et/ou d’un graphique.
Matériel à disposition :
Le logiciel Ez-Rhizo et des images de racines de pois cultivés sur milieu complet ou sur milieu carencé en phosphates.
Un tableur informatique permettant de traiter les données acquises avec le logiciel Ez-Rhizo.
Document 1 : Dynamique et rôle du phosphore dans le sol.
Document 2 : Photographies de pois dans différentes conditions de culture (avec ou sans phosphates)
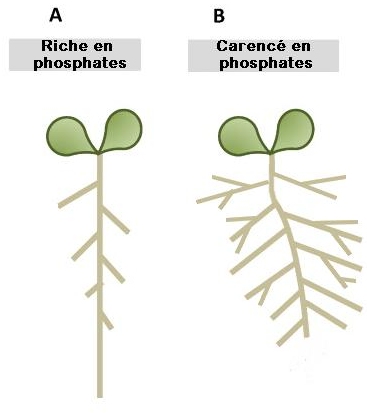
Document 3 : Schémas comparatifs de l’architecture racinaire d’ arabidopsis en milieu complet ou carencé.
Document 1 : Cycle phosphore d’après Charles Karemangingo Ph.
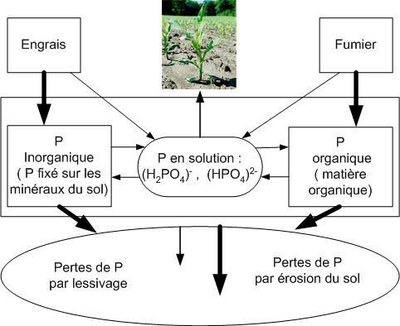
Ministère de l'Agriculture, l'Aquaculture et des Pêches (canada)
http://www.gnb.ca/0173/30/0173300016-f.asp
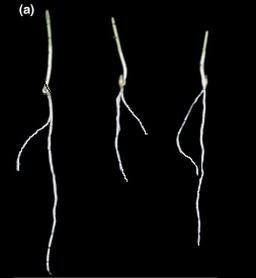
Document 2 : Architecture racinaire de Pois en milieu riche et carencé en phosphates. A traiter par EZ Rhizo.
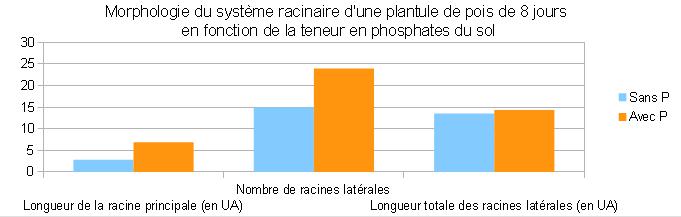
Des plantules de Pois de 3 jours sont déposés dans un rhizotron ( système permettant de visualiser le développement en deux dimensions des racines) rempli de terreau et soumis à un arrosage différent. Voici les résultats obtenus au bout de 10 jours :
 |
 |
| pois arrosé par du liquide complet comprenant du potassium, de l’azote, de l’oxygène et du phosphore = KNOP |
pois arrosé par du KNOP sans phosphore = KNOP sans P. |
L’acquisition d’images de développement racinaire est réalisable par les élèves.
Document 3 : Schémas de l’architecture racinaire de l’Arabidopsis en fonction des conditions du milieu (milieu normal, ou milieux carencés en P, N et S).
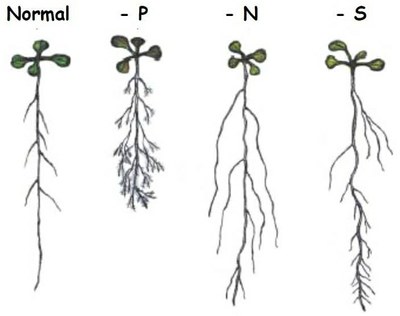
Lopez-Bucio et al, 2003
REPONSES ATTENDUES :
Le logiciel EZ Rhizo permet de détecter et de mesurer un certain nombre de paramètres des racines des plantes, à partir des photographies de l’architecture racinaire, obtenue en deux dimensions dans un rhizotron.
Voici les résultats de détection obtenus
|
|
 pois arrosé par du KNOP sans P. |
| Mesures obtenues par EZ Rhizo | Pois 10 jours KNOP sans P | Pois 10 jours KNOP |
| Longueur racine principale ( en UA ) | 8.13 | 10.74 |
| Nombre de racines latérales | 29 | 19 |
| Longueur totale racines latérales ( en UA ) | 34.99 | 11.4 |
| Longueur moyenne racines latérales ( en UA ) | 0.99 | 0.36 |
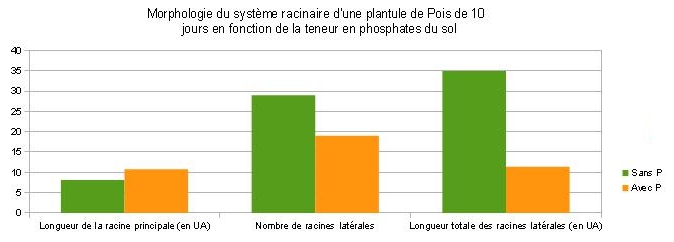
L'environnement de la racine est un déterminant majeur de l’architecture racinaire. Le phosphate étant un élément primordial dans les synthèses végétales, l’architecture racinaire s’adapte à la concentration en phosphates des sols, pour optimiser son utilisation.
|
|
En A : Milieu riche en phosphates, la croissance de la racine principale est importante et les racines secondaires sont peu développées et courtes. En B : Milieu carencé en phosphates, la croissance de la racine principale est ralentie et le réseau de racines secondaires est important et les racines sont plus longues. L’architecture racinaire et le développement des racines latérales s’adaptent à la concentration en phosphates des sols et en cas de carence, l’exploration des horizons superficiels est favorisée au dépend des horizons plus profonds, moins riches en phosphates. |
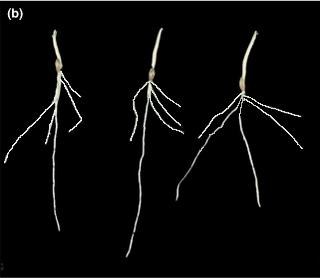
Un autre exemple avec Arabidopsis.
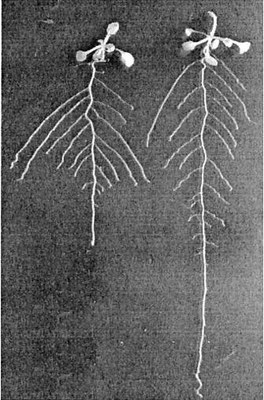 www.ncbi.nlm.nih.gov/pmc/articles/PMC111176/bin/pp0616692001.jpg www.ncbi.nlm.nih.gov/pmc/articles/PMC111176/bin/pp0616692001.jpg |
Arabidopsis, plant de type sauvage, de 14 jours.
|
|
Mesures obtenues après traitement par le logiciel EZ-Rhizo.
|
 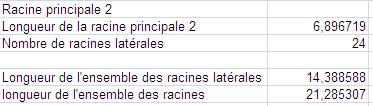 |
POUR ALLER PLUS LOIN : Comment la racine détecte-t-elle la carence en phosphates pour adapter son système racinaire ?
L’arrêt de croissance des racines, en milieu carencé, sous le contrôle de gènes.
- Le laboratoire de biologie du développement des plantes du CEA de Cadarache (Bouche du Rhône) a pour objectif principal d’élucider chez les plantes, les voies de transport et de transduction en réponse aux concentrations ioniques. Il s’est intéressé à cette question en prenant le phosphate comme élément minéral et Arabidopsis thaliana comme plante modèle.
- Il a montré que l’arrêt de la croissance est déclenché à la pointe de la racine. Il existe deux gènes LPR1 et LPR2, commandant deux oxydases à cuivre qui jouent un rôle primordial dans l’arrêt précoce de cette croissance.
- Les racines mutantes continuent à se développer dans un milieu carencé,
- Les racines non mutées s’arrêtent net.
De plus un simple contact de la pointe racinaire avec ce milieu carencé, bloque la croissance, suggérant l’idée que la coiffe est l’organe de détection d’un stress.
Différentes variétés d’Arabidopsis : WT, mutant, double mutant.
| 1) 0 microM de Pi ajouté (c'est-à-dire uniquement le Pi venant de l'agar, 13microM) 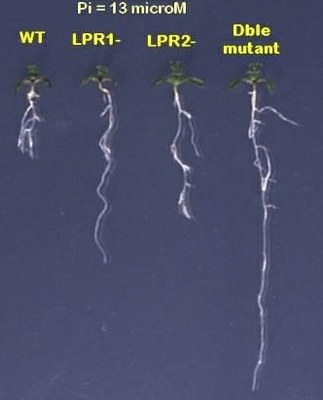 |
2) 500 microM Pi ajouté.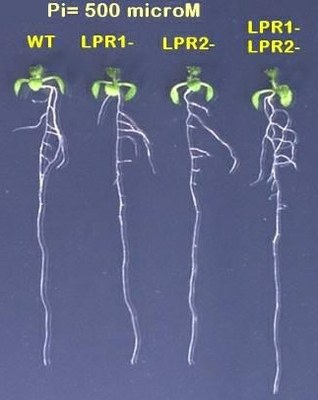 |
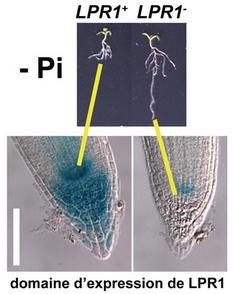 |
- Les plantes d’Arabidopsis dont le gène LPR1 s’ exprime (LPR1+) dans la pointe racinaire, sont sensibles au milieu carencé en phosphates et la croissance de leur racine principale est inhibée. - Les plantes d’Arabidopsis dont le gène LPR1 est moins exprimé (LPR1-) dans la pointe racinaire, sont insensibles au milieu carencé en phosphates et la croissance de leur racine n’est plus inhibée. D’après Thierry Desnos http://www-dsv.cea.fr/institutes/institute-of-environmental-biology-and-biotechnology-ibeb/informations/scientific-results/the-role-of-copper-in-detecting-stress |
Voici des résultats obtenus sur gélose SIGMA, contenant 13 microM de Pi.
De gauche à droite: WT; simple mutant lpr1, simple mutant lpr2, double mutant lpr1,lpr2. d’après photos Thierry Desnos
Remarques :
- Si vous souhaitez tester la réponse d'Arabidopsis sur un milieu carencé en phosphate, il faut que l'agar utilisé en contienne très peu, ce qui n'est malheureusement pas toujours le cas. Par exemple, le phytagel en contient beaucoup. D'un lot à l'autre (et de même référence de catalogue) il peut aussi y avoir de grandes disparités dans la quantité de phosphate! Certains lot contiennent parfois plus de 100 microM de Pi. L’Agar de chez Sigma (A7002, lot: BCBC7507). à 8g/L correspondant à un milieu gélosé contenant 13 microM de phosphate.
- Les résultats de transcriptomique sont en cours d’analyses et la synergie entre les approches génétiques, permettra de mieux connaitre l’origine moléculaire de cet arrêt de croissance.
► Observation de l'architecture racinaire
► La mesure du développement racinaire à l'aide du logiciel EZ-Rhizo